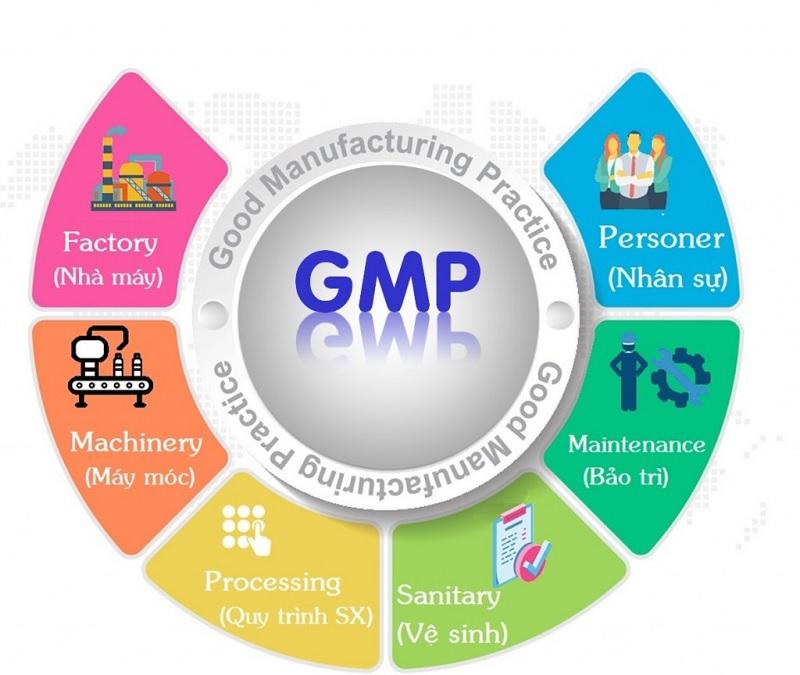
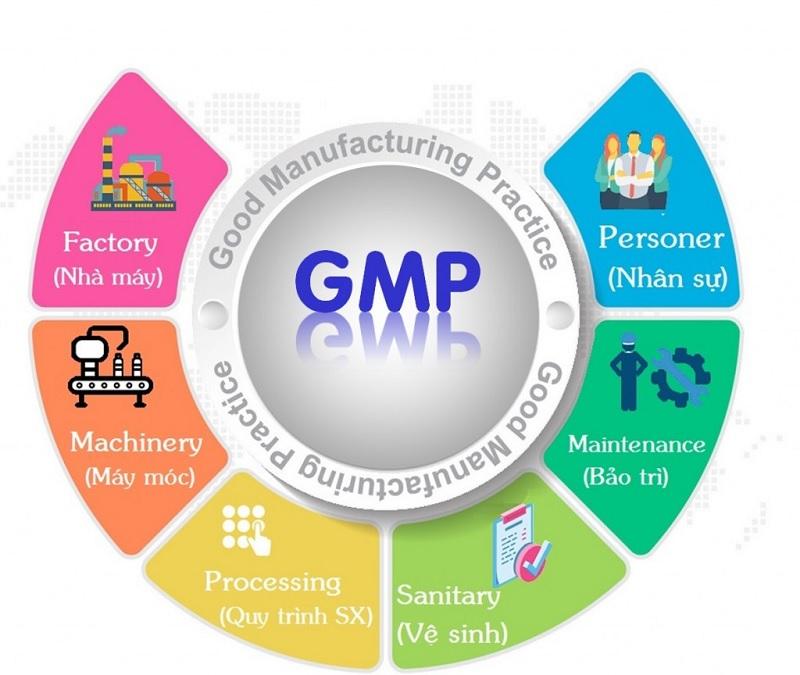
Đối với người mới tiếp cận trong lĩnh vực sản xuất thuốc, việc hiểu về GMP (Good Manufacturing Practice – Thực hành Sản xuất Tốt) và các tiêu chuẩn GMP WHO (Tổ chức Y tế Thế giới) có thể gặp khó khăn và nhầm lẫn.
GMP đề cập đến các quy định và hướng dẫn về việc sản xuất, kiểm soát chất lượng và đảm bảo an toàn trong quá trình sản xuất thuốc. Nó đảm bảo rằng các nhà sản xuất tuân thủ các tiêu chuẩn chất lượng cao nhất để đảm bảo sự an toàn và hiệu quả của sản phẩm.
Tuy nhiên, các tiêu chuẩn GMP WHO là các tiêu chuẩn quốc tế do Tổ chức Y tế Thế giới đặt ra để đảm bảo chất lượng và an toàn của sản xuất thuốc trên toàn cầu. Đây là các quy định cụ thể về hạ tầng, thiết bị, quy trình sản xuất, kiểm tra chất lượng, v.v.
Để giải quyết sự nhầm lẫn và khó khăn trong việc hiểu về GMP và các tiêu chuẩn GMP WHO trong sản xuất thuốc, chúng tôi sẽ cung cấp một mô tả chi tiết về khái niệm GMP, các tiêu chuẩn GMP WHO quan trọng, và cách thức chúng ảnh hưởng đến quy trình sản xuất và chất lượng của sản phẩm. Bài viết sẽ giải thích từng khía cạnh quan trọng của GMP và giúp độc giả hiểu rõ về tầm quan trọng của việc tuân thủ các tiêu chuẩn này trong ngành sản xuất thuốc.
GMP WHO: Chất lượng và an toàn trong sản xuất thuốc
GMP – Thực hành tốt sản xuất dược phẩm
GMP, viết tắt của Good Manufacturing Practice (Thực hành tốt sản xuất), là một phần quan trọng trong quản lý chất lượng. Nó đảm bảo rằng các thuốc, thực phẩm bảo vệ sức khỏe, mỹ phẩm và thuốc thú y được sản xuất và kiểm soát ổn định theo các tiêu chuẩn chất lượng phù hợp với mục đích sử dụng và quy định của giấy phép lưu hành. Đồng thời, GMP giúp giảm thiểu các rủi ro không kiểm soát như nhiễm chéo và nhầm lẫn.
Phạm vi áp dụng của GMP
Thực hành tốt sản xuất thuốc bao gồm cả quá trình sản xuất và kiểm tra chất lượng. Có nhiều hướng dẫn GMP từ các tổ chức khác nhau như GMP ASEAN, GMP EU và GMP WHO. Trong số đó, GMP WHO là hướng dẫn thực hành tốt sản xuất thuốc được Tổ chức Y tế Thế giới xây dựng và phát hành lần đầu vào năm 1968. Hướng dẫn này được áp dụng và tuân thủ bởi hầu hết các cơ sở sản xuất thuốc tại Việt Nam.
Lợi ích của GMP và giấy chứng nhận GMP
Sau khi thiết lập GMP, các cơ sở sản xuất thuốc cần lập hồ sơ pháp lý để được cấp giấy chứng nhận GMP. Giấy chứng nhận này không chỉ tăng đáng kể uy tín của doanh nghiệp trong mắt khách hàng, mà còn nâng cao hiệu suất sản xuất và giảm thiểu các rủi ro trong quá trình sản xuất. Điều này đồng nghĩa với việc đảm bảo chất lượng và an toàn của sản phẩm thuốc, đồng thời thể hiện sự cam kết với quy trình sản xuất tốt nhất.
GMP WHO không chỉ đảm bảo chất lượng và an toàn trong quá trình sản xuất thuốc, mà còn đóng vai trò quan trọng trong việc xây dựng uy tín và đáng tin cậy cho các cơ sở sản xuất. Bằng cách tuân thủ GMP và đạt được giấy chứng nhận GMP, các doanh nghiệp có thể tăng cường sự tin tưởng từ phía khách hàng và góp phần vào sự phát triển bền vững của ngành công nghiệp sản xuất thuốc.
Tiêu chuẩn trong GMP WHO: Tổ chức nhân sự, cơ sở sản xuất và máy móc thiết bị
Tổ chức nhân sự
Quy định chung: Đảm bảo có đủ nhân viên có trình độ chuyên môn và kinh nghiệm cần thiết. Các cán bộ phải có mô tả công việc cụ thể và được giao quyền thích hợp để thực hiện trách nhiệm. Tất cả nhân viên phải nắm bắt nguyên tắc GMP liên quan và nhận đào tạo ban đầu và liên tục liên quan đến yêu cầu công việc của mình.
Nhân sự chủ chốt: Bao gồm người được ủy quyền, trưởng bộ phận sản xuất và trưởng đơn vị chất lượng. Cần có trình độ chuyên môn và kinh nghiệm theo quy định quốc gia. Chuyên ngành đào tạo bao gồm hóa học, kỹ thuật hóa học, vi sinh, khoa học và công nghệ dược, dược lý và độc chất học, sinh lý học và các ngành khoa học liên quan.
Đào tạo: Áp dụng đào tạo cho tất cả nhân viên trong khu vực sản xuất, phòng kiểm tra chất lượng và các nhân viên khác liên quan đến chất lượng. Nhân viên làm việc trong khu vực đặc biệt như khu vực có nguy cơ bị tạp nhiễm, khu vực sạch, khu vực xử lý nguyên vật liệu độc hại được đào tạo cụ thể. Khách tham quan và nhân viên chưa qua đào tạo nên tránh tiếp xúc với khu vực sản xuất và kiểm tra chất lượng, nếu không tránh được, họ cần được thông báo và tuân thủ các yêu cầu GMP, đồng thời được trang bị trang phục bảo hộ.
Cơ sở sản xuất
Thiết kế và bố trí hợp lý: Thiết kế và bố trí nhà máy phải giảm thiểu nguy cơ sai sót. Khu vực sinh bụi phải có biện pháp tránh nhiễm chéo và dễ dàng vệ sinh.
Bảo dưỡng và vệ sinh: Cần bảo dưỡng cẩn thận và làm vệ sinh, tẩy trùng khi cần thiết. Điện, ánh sáng, nhiệt độ, độ ẩm, thông gió phải đảm bảo phù hợp.
Máy móc thiết bị
Thiết kế và bảo dưỡng: Máy móc thiết bị phải được thiết kế, bố trí, điều chỉnh và bảo dưỡng phù hợp với các thao tác thực hiện. Đảm bảo hạn chế nguy cơ sai sót và tạp nhiễm.
Vệ sinh máy móc thiết bị: Máy móc thiết bị phải được làm vệ sinh toàn diện theo lịch trình cụ thể. Không gây nguy hiểm trong quá trình sản xuất. Sử dụng thiết bị khép kín khi cần.
Lưu giữ bản vẽ: Cần lưu giữ bản vẽ của máy móc thiết bị và hệ thống phụ trợ.
Thông qua các tiêu chuẩn trong GMP WHO, đảm bảo sự tổ chức nhân sự, cơ sở sản xuất và máy móc thiết bị tuân thủ các yêu cầu và quy định chất lượng, góp phần vào việc sản xuất thuốc an toàn và hiệu quả.
Vệ sinh cá nhân
Vệ sinh cá nhân: Quá trình tắm giúp loại bỏ tế bào da chết và vi sinh vật gây bệnh. Đánh răng giúp loại bỏ thức ăn và vi sinh vật. Đồng phục làm việc sạch, đi găng tay và giày chuyên dụng. Giữ móng tay sạch sẽ, cắt ngắn và không sơn móng tay. Nếu có bất kỳ dấu hiệu bệnh tật nào ảnh hưởng đến chất lượng sản phẩm, không tham gia vào quá trình sản xuất.
Vệ sinh nhà xưởng: Nhà xưởng cần được thiết kế để dễ vệ sinh. Giữ gọn gàng, sạch và không để đọng nước. Sàn cần có độ nghiêng để thoát nước. Khu rửa tay, thay quần áo và nhà vệ sinh nên được đặt ở vị trí thích hợp. Nhà vệ sinh không được kết nối trực tiếp với khu vực sản xuất và lưu trữ.
Nguyên tắc làm vệ sinh: Làm vệ sinh từ nơi sạch nhất đến nơi bẩn nhất, từ cao xuống thấp, từ sau ra trước, từ nơi trọng yếu đến nơi ít trọng yếu, từ góc xa nhất đến cửa ra khỏi phòng. Làm sạch phòng có cấp sạch cao hơn trước. Sử dụng xô và đầu giẻ lau theo tiêu chuẩn ISO. Đeo găng kép khi làm vệ sinh miệng thoát nước trên sàn. Vệ sinh dụng cụ và thiết bị phải được làm sạch cả bên trong và bên ngoài sau khi sử dụng theo quy trình đã được thiết lập.
Nguyên vật liệu
Lưu trữ nguyên vật liệu: Không một nguyên vật liệu nào được tiếp xúc trực tiếp với sản phẩm trong quá trình vệ sinh, bôi trơn thiết bị và kiểm soát côn trùng. Tất cả nguyên liệu đầu vào phải được lưu trữ ngay sau khi nhận hoặc chế biến cho đến khi sử dụng hoặc phân phối. Cần bảo quản tất cả nguyên liệu và sản phẩm trong điều kiện phù hợp theo quy định của nhà sản xuất và tuân thủ nguyên tắc hết hạn trước (FEFO).
Nước sử dụng trong sản xuất: Nước sử dụng trong sản xuất dược phẩm phải đáp ứng các yêu cầu phù hợp với mục đích sử dụng.
Hồ sơ tài liệu
Thiết kế và quản lý hồ sơ tài liệu: Hồ sơ tài liệu cần được thiết kế, soạn thảo, rà soát và phân phát một cách cẩn thận. Hồ sơ tài liệu phải được người có thẩm quyền phê duyệt, ký và ghi ngày tháng, không được thay đổi khi chưa được phép. Nội dung của hồ sơ tài liệu phải rõ ràng. Hồ sơ tài liệu phải được rà soát và cập nhật thường xuyên. Bất kỳ thay đổi nào về tài liệu cũng phải được ký và ghi rõ ngày tháng. Cần lập hoặc hoàn tất hồ sơ tài liệu khi tiến hành bất kỳ hoạt động nào.
Các nguyên tắc cơ bản trong GMP WHO
Các nguyên tắc trong GMP WHO nhằm mục tiêu quản lý chặt chẽ và giảm thiểu nguy cơ trong quá trình sản xuất thuốc. Dưới đây là 10 nguyên tắc cơ bản trong GMP WHO:
- Xác định rõ quy trình sản xuất: Mọi quy trình sản xuất phải được xác định rõ ràng, được rà soát về nguy cơ tiềm tàng và cho thấy khả năng sản xuất các loại thuốc, thực phẩm chức năng, hóa mỹ phẩm đạt yêu cầu chất lượng.
- Kiểm nghiệm và quản lý chất lượng: Việc kiểm nghiệm và quản lý chất lượng phải được thực hiện đảm bảo sản phẩm đáp ứng các tiêu chuẩn chất lượng.
- Cung cấp nguồn lực đầy đủ: Đảm bảo có đủ nhân viên có trình độ chuyên môn và đào tạo, nhà xưởng và không gian phù hợp, máy móc thiết bị và dịch vụ phù hợp, nguyên vật liệu bao bì nhãn mác đạt tiêu chuẩn, quy trình và hướng dẫn đã được thẩm định và phê duyệt, cũng như bảo quản và vận chuyển phù hợp.
- Hướng dẫn và quy trình rõ ràng: Các hướng dẫn và quy trình phải được viết rõ ràng, dễ hiểu.
- Đào tạo công nhân vận hành: Công nhân vận hành phải được đào tạo để thực hiện đúng các tiêu chuẩn GMP.
- Ghi chép đầy đủ: Quá trình sản xuất phải được ghi chép đầy đủ để cho thấy việc thực hiện đúng quy trình và hướng dẫn. Điều này giúp dễ dàng tìm ra nguyên nhân khi xảy ra sai lệch, từ đó có biện pháp khắc phục và phòng ngừa thích hợp.
- Lưu trữ hồ sơ sản xuất và phân phối: Hồ sơ ghi lại việc sản xuất và phân phối phải được lưu trữ theo mẫu để đảm bảo dễ dàng tra cứu lại toàn bộ lịch sử của một lô sản xuất.
- Bảo quản và phân phối theo GMP: Các thuốc, thực phẩm bảo vệ sức khỏe, hóa mỹ phẩm, thuốc thú y phải được bảo quản và phân phối theo đúng các hướng dẫn trong thực hành tốt phân phối thuốc (GDP).
- Hệ thống thu hồi sản phẩm: Cần có hệ thống thu hồi bất kỳ sản phẩm nào đang được bán hoặc cung cấp.
- Xử lý khiếu nại: Các khiếu nại về sản phẩm đang lưu hành phải được kiểm tra, tìm ra nguyên nhân và áp dụng biện pháp phù hợp để ngăn chặn sự tái diễn các sai sót trong sản phẩm.
Bài viết đã cung cấp một cái nhìn tổng quan về GMP (Thực hành Sản xuất Tốt) và các tiêu chuẩn GMP WHO (Tổ chức Y tế Thế giới) trong sản xuất thuốc.
Chúng tôi hy vọng rằng thông tin này đã giúp bạn hiểu rõ về quan trọng của việc tuân thủ các quy định và hướng dẫn này trong ngành công nghiệp sản xuất thuốc. Sự tuân thủ GMP và tiêu chuẩn GMP WHO đảm bảo rằng quá trình sản xuất thuốc được thực hiện theo các tiêu chuẩn cao nhất để đảm bảo chất lượng, an toàn và hiệu quả của sản phẩm. Việc đảm bảo tuân thủ GMP và GMP WHO là một bước quan trọng để đảm bảo sự tin cậy và uy tín của các sản phẩm thuốc trên thị trường.