Khí SO2
Khí sunfurơ (SO2): Đặc điểm, mùi, ứng dụng và tác động
Khí sunfurơ (SO2) là một chất khí có thể gây ra nhiều vấn đề nghiêm trọng liên quan đến môi trường và sức khỏe con người. Một trong những vấn đề chính là tác động tiêu cực của khí SO2 đến môi trường, gây ra hiện tượng ô nhiễm không khí và mưa axit. Không chỉ vậy, khí SO2 còn góp phần làm gia tăng hiệu ứng nhà kính, gây biến đổi khí hậu và ảnh hưởng tới hệ sinh thái.
Hơn nữa, mùi hắc hơi đặc trưng của SO2 cũng gây khó chịu và ảnh hưởng tới sức khỏe hô hấp của con người.
Tuy nhiên, việc hiểu rõ về khí sunfurơ là điều cần thiết để chúng ta có thể ứng phó và giảm thiểu tác hại của nó. Cần có những giải pháp khoa học và công nghệ để giảm thiểu khí SO2 từ các nguồn phát thải công nghiệp và phương tiện giao thông. Ngoài ra, cần tăng cường giám sát và kiểm soát chất lượng không khí để phát hiện và giải quyết kịp thời các tình huống ô nhiễm nghiêm trọng.
Bài viết này sẽ giúp bạn hiểu rõ hơn về khí sunfurơ – SO2, từ đặc điểm và mùi gì của nó cho đến ứng dụng và tác hại của khí này. Chúng ta sẽ tìm hiểu cách giảm thiểu tiềm ẩn các vấn đề môi trường và sức khỏe mà SO2 có thể gây ra thông qua các giải pháp và biện pháp ứng phó hiệu quả. Hy vọng bài viết sẽ cung cấp thông tin hữu ích và khuyến khích mọi người hành động để bảo vệ môi trường và sức khỏe của chúng ta.
Khí Sunfurơ (SO2): Mô tả và Tính chất
Khí sunfurơ là gì và cách nhận biết
Khí sunfurơ, còn gọi là lưu huỳnh đioxit, là loại khí được tạo ra trong quá trình đốt cháy nhiên liệu hóa thạch hoặc nung chảy quặng kim loại. Khi núi lửa phun trào, hàng triệu tấn khí SO2 được giải phóng ra. Để nhận biết khí SO2, bạn có thể dựa vào mùi hắc đặc trưng, khả năng làm vẩn đục nước sôi và khiến dung dịch brom mất màu.
Cấu trúc và tính chất vật lý của khí SO2
Khí SO2 có công thức hóa học là SO2, với tính chất vật lý là một chất khí nặng hơn không khí, không màu và thường có mùi hắc. Nó dễ tan trong nước với điểm nóng 72°C và điểm sôi -10°C. Khí SO2 cũng có khả năng làm vẩn đục nước sôi và làm mất màu dung dịch brom.
Tính chất hóa học của khí SO2
Khí SO2 là oxit axit, khi tan trong nước tạo thành dung dịch axit sunfurơ (H2SO3). Nó có thể tác dụng với dung dịch bazơ tạo thành hai loại muối là muối trung hoà chứa ion sunfit (SO3) và muối axit chứa ion hidrosunfit (HSO3). Ngoài ra, SO2 cũng thể hiện tính oxi hóa khi tác dụng với các chất khử mạnh hơn, và tính khử khi tác dụng với các chất oxi hóa mạnh hơn.
Cách nhận biết và điều chế khí Sunfurơ (SO2)
Cách nhận biết khí SO2 dễ dàng
Khí Sunfurơ (SO2) có thể dễ dàng nhận biết bằng cách sục khí vào dung dịch brom hoặc thuốc tím. Nếu dung dịch mất màu, thì khí đó chính là SO2.
Phản ứng hóa học:
- Br2 + SO2 + 2H2O → 2HBr + H2SO4
- 2KMnO4 + 5SO2 + 2H2O → 2MnSO4 + K2SO4 + 2H2SO4
Ngoài ra, còn có các cách khác:
- Sục khí qua dung dịch iot. Nếu dung dịch nhạt màu đi thì đó là SO2.
- Cho khí phản ứng với dung dịch H2S. Nếu phản ứng tạo ra bột màu vàng thì khí đó là SO2.
- Sục khí từ từ đến dư vào dung dịch nước vôi hoặc bari hidroxit. Nếu nước xuất hiện vẩn trắng đục, sau đó nước trở nên trong suốt, thì đó là SO2.
Lưu ý: Khí SO2 là độc hại, hít phải có thể gây viêm đường hô hấp, nên cần thực hiện trong tủ hút và cẩn trọng khi làm thí nghiệm.
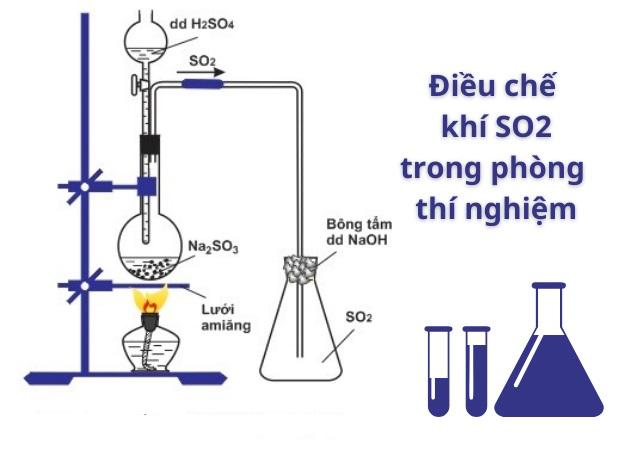
Cách điều chế khí SO2 trong phòng thí nghiệm và công nghiệp
Trong phòng thí nghiệm: Khí SO2 được điều chế trong phòng thí nghiệm thông qua phản ứng hóa học sau:
Na2SO3 + H2SO4 → Na2SO4 + H2O + SO2
Trong công nghiệp: Khí SO2 được điều chế trong công nghiệp thông qua một số cách sau:
- Đốt cháy lưu huỳnh: S + O2 → SO2
- Phản ứng với axit sunfuric đặc nóng: Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
- Đốt cháy hidro sunfua trong khí oxi dư: 2H2S + 3O2 → 2H2O + 2SO2
- Đốt quặng pirit sắt: 4FeS2 + 11O2 → 2Fe2O3 + 8SO2
Các phương pháp này giúp điều chế khí SO2 theo quy mô phòng thí nghiệm và công nghiệp một cách hiệu quả.
Tác hại của Khí Sunfurơ (SO2)
Ảnh hưởng đối với môi trường
Khí SO2 là một nguy hại nghiêm trọng đối với môi trường. Nó thường xuất hiện trong khí thải từ nhà máy, phương tiện giao thông, khói thuốc lá và hệ thống lò sưởi, sấy. Khí SO2 được sinh ra từ quá trình nấu chảy kim loại hoặc đốt cháy nhiên liệu như than, dầu.
Khi tác động với nước mưa, SO2 tạo thành axit sunfuric, gây hiện tượng mưa axit ảnh hưởng đến hệ sinh thái động và thực vật. Nồng độ mưa axit cao gây hại lá cây, ngăn cản sự phát triển bình thường của cây. Trong không khí ẩm, khí SO2 phản ứng với hơi nước tạo ra axit, gây ăn mòn kim loại và bê tông, thay đổi màu sắc đá vôi và làm mỏng tầng ozon.
Ảnh hưởng đối với con người
Khí SO2 tác động với các hợp chất khác trong không khí tạo thành hạt mịn, làm giảm tầm nhìn. Khi nồng độ SO2 ở mức 0,3-1,0 phần triệu, chúng ta cảm nhận được mùi khó chịu. Nồng độ cao hơn 3 phần triệu, SO2 có mùi gắt khó chịu.
Trong hỗn hợp với hạt rắn và axit sunfuric, khí SO2 gây khó thở và các bệnh phổi. Nếu hàm lượng SO2 tăng lên, số ca tử vong cũng tăng. Khí SO2 khi đi vào máu gây phản ứng hóa học giảm lượng dự trữ kiềm, gây rối loạn chuyển hóa protein và đường, gây thiếu vitamin B và C. Nó còn gây tắc nghẽn mạch máu, làm giảm khả năng vận chuyển oxy của hồng cầu. Tiếp xúc với da có thể gây sưng, bỏng và thậm chí là hoại tử.
Xử lý hiệu quả khí Sunfurơ (SO2)
Phương pháp Hấp thụ bằng Amoniac
Để giảm tác hại của khí SO2, ta áp dụng phương pháp hấp thụ bằng Amoniac. Khí SO2 sẽ được hấp thụ trong dung dịch amoniac hoặc sunfit – bisunfit amon. Dưới các phản ứng hóa học, amoniac và khí SO2 trong dung dịch nước tạo thành muối amoni sunfit. Sau đó, muối này tiếp tục phản ứng tạo ra muối amoni bisunfit. Quá trình phản ứng diễn ra như sau:
- NH4 + H2O + SO2 → (NH4)2SO3
- H2O + SO2 + (NH4)2SO3 → 2NH4HSO3
- 2NH4HSO3 (tới) → (NH4)2SO3 + H2O + SO2
- Có thể: (NH4)2SO3 + 2NH4HSO3 → 2(NH4)2SO4 + S + H2O
- S + (NH4)2SO3 → (NH4)2S2O3
- 2NH4HSO3 + (NH4)2S2O3 → 2(NH4)2SO4 + 2S + H2O
Phương pháp Hấp thụ bằng CaCO3 hoặc CaO
Phương pháp hấp thụ SO2 bằng dung dịch Ca(OH)2 cũng được sử dụng rộng rãi, có thể xử lý đến 85 – 90% lượng khí SO2. Cách thức xử lý như sau:
Khí thải được đưa qua hệ thống xử lý từ dưới lên, trong đó khí SO2 và bụi bẩn được giữ lại, chỉ có không khí sạch thoát ra ngoài. Dung dịch Ca(OH)2 được bơm lên phần trên của thân trụ và phun ra bằng hệ thống dàn phun sương để tưới đều dung dịch trong tháp.
Khí từ dưới lên tiếp xúc với dòng chất lỏng từ trên xuống làm SO2 bị giữ lại. Các phản ứng hóa học xảy ra như sau:
- 2SO2 + Ca(OH)2 → Ca(HSO3)2
- Ca(HSO3)2 + Ca(OH)2 → 2CaSO3 + 2H2O
CaSO3 là chất rắn ít tan, lắng xuống đáy tháp và được chôn lấp sau đó.
Như vậy, các phương pháp xử lý trên giúp giảm thiểu tác hại của khí SO2 đối với môi trường và con người.
Trong tổng kết, khí sunfurơ (SO2) đã được xác định là một chất khí có tác động tiêu cực đến môi trường và sức khỏe con người. Mùi hắc hơi của SO2 không chỉ gây khó chịu mà còn có thể ảnh hưởng đến sức khỏe hô hấp. Các vấn đề ô nhiễm không khí, mưa axit và biến đổi khí hậu cũng liên quan chặt chẽ đến khí SO2.
Tuy nhiên, hiểu biết và ứng dụng kiến thức về SO2 có thể giúp giảm thiểu tác hại của nó. Qua việc áp dụng các giải pháp và biện pháp khoa học, chúng ta có thể hạn chế nguồn phát thải SO2 từ các nguồn công nghiệp và phương tiện giao thông, giám sát và kiểm soát chất lượng không khí để bảo vệ môi trường và sức khỏe con người.
Hi vọng bài viết này đã cung cấp thông tin hữu ích và khuyến khích mọi người tham gia vào việc bảo vệ môi trường và sức khỏe của chúng ta khỏi tác động tiêu cực của khí sunfurơ.